王宝俊团队揭示II型CRISPR系统crRNA-tracrRNA配对的可编程机制及其RNA检测应用
基因编程,如今已经成为全球关注焦点,2020年的诺贝尔化学奖就颁给了这一技术,它被称为生物科学领域的“游戏规则改变者”,在医药、农业和工业生物技术等领域具有广泛的应用前景,而CRISPR系统的可编程性是使其成为热门基因工程工具的关键。
天然的II型CRISPR系统有着双RNA介导的DNA靶向机制,其gRNA由crRNA与tracrRNA配对组成[1]。然而,自CRISPR/Cas9系统工程化之初,crRNA和tracrRNA就往往被融合为单RNA分子(sgRNA)使用,以利基因工程操作。crRNA与tracrRNA之间的匹配是否存在可编程性是一个长期被忽视的问题。
2022年4月11日,浙江大学杭州国际科创中心生物与分子智造研究院王宝俊研究团队在Nature Communications 合作发表长文 “Reprogrammed tracrRNAs enable repurposing of RNAs as crRNAs and sequence-specific RNA biosensors”,系统性揭示了crRNA与tracrRNA匹配的可编程性,并利用重编程tracrRNA展示了多个合成生物学强大应用案例。包括首次揭示重编程tracrRNA-crRNA对的设计原则和正交性,开发双gRNA介导的CRISPR激活(CRISPRa)系统,可编程AND-gate逻辑门装置,劫持细菌内源性环境响应基因转录本(含sRNA和mRNA)探测环境污染物,发明高特异性SARS-CoV-2病毒RNA传感器AGATHA。

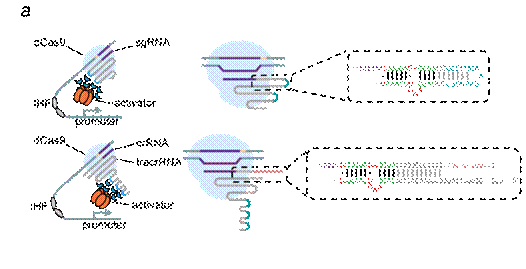
图1 Dual-RNA介导的CRISPR基因激活装置
(图源:Liu Y, et al., Nat Commun, 2022)
一、II型CRISPR系统crRNA-tracrRNA配对的可编程机制
II型CRISPR系统crRNA与tracrRNA匹配的可编程性有着巨大的利用价值,这一潜力长期以来被学界忽视。作者在开发原核CRISPR激活装置的过程中[2],注意到sgRNA scaffold能够容忍RNA碱基对的替换,由此推测crRNA与tracrRNA配对形成的repeat/anti-repeat区域应具有一定程度的可编程性。通过将之前开发的CRISPR激活装置改造为双RNA(dual-RNA)介导的CRISPRa系统,crRNA-tracrRNA配对令人惊讶的可编程性被揭示出来(图1)。研究团队构建的随机成对序列文库测试结果显示,高达70%的重编程crRNA-tracrRNA对保留了WT序列50%以上的gRNA活性。基于上述发现,作者开发出一套仅通过改变crRNA-tracrRNA配对区序列即可实现高度正交性的“与”门(AND-gate)装置,扩展了合成生物学可编程生物计算元件工具箱(图2)。

图2 crRNA-tracrRNA配对区域具有高度可编程性,被用于搭建可编程“与”门
(图源:Liu Y, et al., Nat Commun, 2022)
随后,作者做出了大胆猜想。II型CRISPR系统的crRNA结构十分简单,仅包含两个部分,即靠近5‘端的spacer序列与靶DNA配对,和靠近3’端的repeat序列与tracrRNA的anti-repeat区段配对。crRNA的spacer可以通过改变序列来引导gRNA靶向不同DNA序列,而传统上repeat序列被认为是与相应Cas蛋白共进化的产物[3],具有一定保守性或不可变性。作者认为,既然crRNA的spacer段和repeat段序列都可以改变,那么意味crRNA没有序列上的绝对限制,反过来,任何序列的RNA分子都可能可以扮演crRNA的角色。这就意味着,我们可以按照自己的意愿,对自然界存在的生命体进行改造。
为了证实这一猜想,研究团队选择红色荧光蛋白RFP的mRNA进行了测试。结果证明,RFP的mRNA可以与tracrRNA及dCas9蛋白形成功能性CRISPRa复合体并激活相应启动子(图3)。通过对重编程tracrRNA进行优化,mRNA诱导的启动子激活可以达到50倍以上的调控倍数。而更令人惊讶的是,CRISPRa复合体对mRNA的劫持与mRNA的翻译过程没有显著的干扰效应。
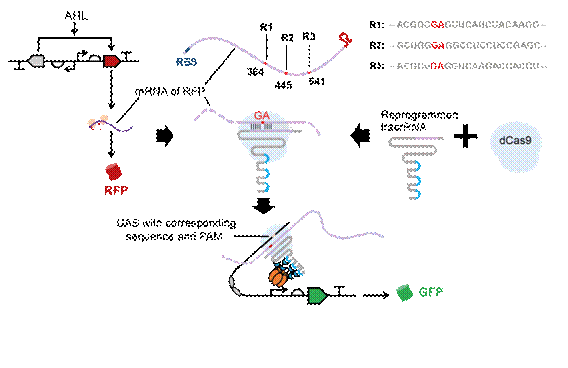
图3 重编程tracrRNA劫持mRNA形成CRISPRa复合体激活靶启动子
(图源:Liu Y, et al., Nat Commun, 2022)
二、应用场景广阔新冠检测也可用上它!
通过重编程tracrRNA这种简单方式即可劫持体内外特定RNA分子以激活指定基因,是科学家长期以来梦寐以求的基因工程工具,应用场景极为广阔。
为了展示这一基因网络重构工具的强大功能和通用性,作者利用不同的tracrRNA,劫持了来自大肠杆菌基因组砷响应基因、氧化应激基因、锌/铅离子响应基因、锌/镉响应基因和铜离子响应基因的转录本(含mRNA和sRNA),并成功将这些基因的活动与人工报告基因线路相连,从而实现对细菌生长环境中砷、过氧化物、锌、铅、铜的高效探测(图4)。
与在细胞中转入人工构建的生物传感器线路相比,劫持大肠杆菌自身传感器基因转录本,不大幅干扰和改变宿主细胞中关键感受器蛋白的浓度和靶启动子拷贝数,也不额外激活宿主细胞中潜在相关的反馈调节,得以让原核生物在漫长演化过程中形成的环境响应机制为人类直接工作。
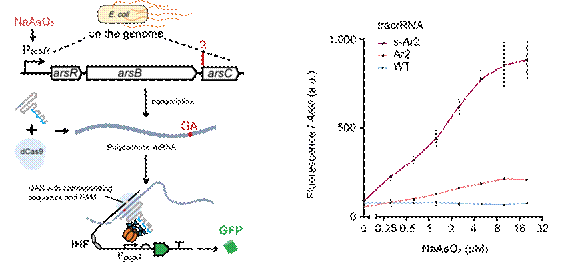
图4 劫持大肠杆菌内源性转录本探测环境砷元素
(图源:Liu Y, et al., Nat Commun, 2022)
不仅如此,研究团队还将这一原理应用于新冠病毒SARS-CoV-2核酸的体外检测。简单来说,就是运用上他们的新技术,可以在短短10分钟内,就得知新冠病毒核酸是否存在!
具体如何实现呢?原来团队设计了一种新型的无细胞系统检测装置,通过在该装置内引入一段“AGATHA”DNA序列表达一个处于“抑制”状态的Broccoli荧光RNA配体。当在该装置内加入病毒RNA时,重编程的tracrRNA可以劫持该病毒RNA分子并与Cas9形成CRISPR复合体从而切割目的DNA片段,使得处于“抑制”状态的Broccoli荧光RNA配体得到释放,并与荧光蛋白DFHBI相结合,产生荧光信号的积累。
实验证明,该体系可以在添加病毒RNA后的10分钟内快速累积足量Broccoli RNA以报告新冠病毒核酸的存在。该体系被其设计者命名为非典型gRNA介导转录终止告警系统“阿加莎”——Atypical gRNA-activated Transcription Halting Alarm(AGATHA)(图5)。与传统的RNA检测方法相比,该无细胞检测系统具有易于使用、便携、安全、低成本的特点,同时基于tracrRNA的可编程性,该方法还可以检测其他病毒RNA、各种RNA生物标志物,在医药、工业生物技术领域具有广泛的应用前景。
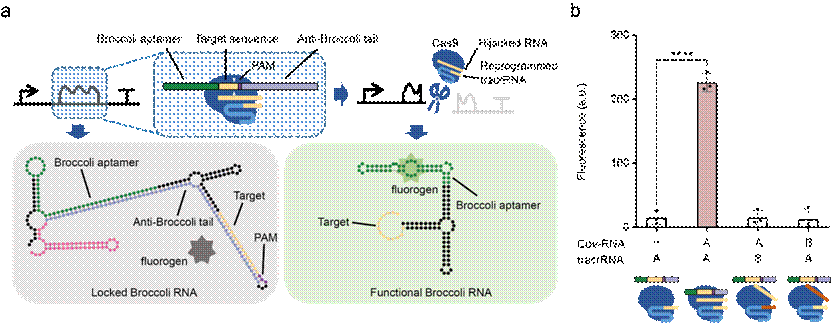
图5 非典型gRNA介导转录终止告警系统“阿加莎”探测新冠病毒核酸
(图源:Liu Y, et al., Nat Commun, 2022)
综上,本研究系统揭示了II型CRISPR系统crRNA-tracrRNA配对的可编程性机制,并展示了基于该机制传感检测多种细胞內源RNA和体外病毒RNA的强大应用,拓展了II型CRISPR Cas9系统新的应用场景和CRISPR系统在生物传感与疾病治疗方面的潜力。利用重编程的tracrRNA劫持各种RNA分子激活CRISPR系统,将为编程生物学带来无穷可能性,例如重建细胞内的基因调控网络拓朴结构、开发新型RNA编辑器和RNA细胞内标记方法、设计复杂的细胞生物计算线路。
刘阳博士为本文的第一作者。本项研究获得了众多合作实验室的鼎力支持和帮助,包括清华大学谢震教授团队,英国爱丁堡大学的Chris French教授团队、克兰菲尔德大学杨竹根博士和格拉斯哥大学Jon Cooper院士团队。

王宝俊教授简介:
王宝俊教授团队长期从事合成生物学使能技术开发、基因线路工程化设计及在生物传感、生物制造等领域的创新应用方向的前沿研究。王宝俊教授2011年毕业于英国帝国理工学院获生物工程博士学位,2013年加入英国爱丁堡大学任合成生物学助理教授,2019年晋升终身教授,2022年1月加入浙江大学浙江大学化学工程与生物工程学院任求是特聘教授,现任浙江大学杭州国际科创中心生物与分子智造研究院副院长、合成生物学研究所所长。近三年以通讯作者发表重要学术论文20余篇(包括Nature Chem Biol, Nature Commun 等6篇Nature子刊论文)[1],作为项目负责人主持二十余项研究基金(总额约6000万人民币)。曾获得重要奖项有:2015年盖茨基金会全球大挑战探索基金奖;2016年英国生物技术与科学基金会新研究员奖、维康基金会科学种子基金奖;2019年英国自然科学基金会杰出青年科学基金奖(全英仅41人);2020年入选英国皇家化学学会会士(FRSC)。课题组长期邀请对合成生物学使能技术工具开发、基因线路设计及创新应用有兴趣的学者(浙大科创百人、青年人才研究员、博士后、工程师、研究生等)加盟团队或者探讨课题合作。
感兴趣者可将简历、拟申请岗位和工作设想发送邮件至 baojun.wang@zju.edu.cn
原文链接:
https://doi.org/10.1038/s41467-022-29604-x
1. Jinek, M., et al. (2012). A programmable dual-RNA guided DNA endonuclease in adaptive bacterial immunity. Science 337(6096): 816-821.
2. Liu, Y., Wan, X. & Wang, B. Engineered CRISPRa enables programmable eukaryote-like gene activation in bacteria. Nature Communications 10, 3693, (2019).



