如果把生命的本质看做编码,代码构成了生命的表达,那么基因就是所用的函数。“基因编辑”听起来酷炫,正是因为它能在基因组特定位置增加、删除、替换DNA序列。可以说,基因编辑技术重塑了生命代码。
近日,我院合成生物研究所鲍泽华研究员团队在基因编辑技术上实现了新的突破。团队开发出SpiG变体,突破了酿酒酵母中精确基因编辑的范围限制。在此基础上通过高通量DNA设计合成,创建出一种新型的饱和基因编辑方法“CHASE”,能更全面地解析基因型-表型关系及挖掘有益突变,促进蛋白质及酿酒酵母细胞工厂的进化改造。相关成果发表在《Science Advances》。

相较以往,
我们的技术为何更高效精准?
理解遗传变异对生物表型的影响是分子遗传学的核心目标,同时也是实施合成生物学研发的基础。为了在基因原位评估遗传变异的影响,研究人员已经开发出多种内源基因突变技术。
但现有的技术有一定缺陷,比如说“delitto perfetto”的两步定点突变技术,必须要有特定的菌株才能做突变,这导致技术应用灵活性低,传播性也不高;再比如许多基于CRISPR基因编辑技术衍生的技术,像Cas9偶联易错DNA聚合酶、碱基编辑器和MutaT7等这些技术的相邻突变频率较低,会导致某些种类的氨基酸转化无法实现,编辑范围受到限制。

“克服基因编辑范围限制,是我们团队研究的一大亮点” 鲍泽华研究员解释道。许多基因编辑技术中,Cas9的靶向位点过于依赖5′-NGG形式的原间隔相邻基序,团队在前期开发的CHAnGE技术基础上进行革新,实现了酿酒酵母中宽松原间隔相邻基序处高效精准的基因编辑。
团队继而通过高通量DNA设计合成,开发出一种新型的饱和基因编辑方法:CRISPR-Cas9和HDR辅助饱和编辑(CHASE)。这一方法可以实现酿酒酵母菌株中kbp范围内的基因饱和突变(图1),相较于以往方法显著拓宽了编辑范围,有利于更全面地解析基因型-表型关系及挖掘有益突变,促进蛋白质及酿酒酵母细胞工厂的进化改造。
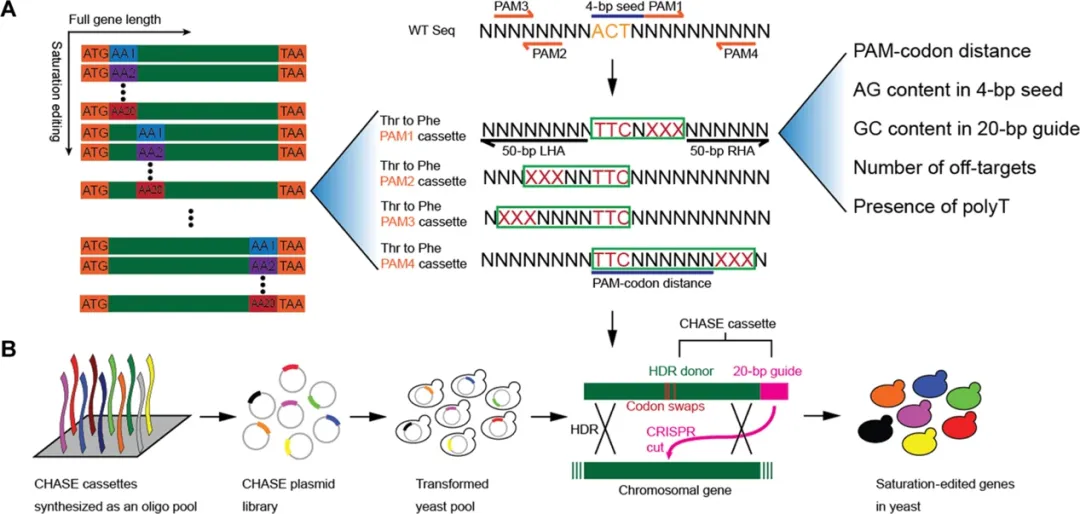
图 1. CHASE的原理图
面向未来,CHASE可以如何应用?
“我们的实验中会制造出成千上万的突变,需要挑选出其中的有益突变,从而确保这种编辑是有意义的以促进改造。目前我们团队已经实现了内源转录因子、外源酶蛋白以及膜蛋白的突变筛选工作(未发表),都发现了其中的有益突变。”本文一作、工程师邓磊说道。
团队这些进展得益于前人的积累和整个基因编辑领域对PAM宽松Cas蛋白的改造。鲍泽华研究员表示:“基因突变技术历史上得过三次诺贝尔奖,包括1993年的寡核苷酸定点诱变技术、2018年的定向进化技术和2020年的基因编辑技术,完成了从体外突变到体内突变的突破。我们的工作更像是站在巨人的肩膀上,将寡核苷酸突变合成和基因编辑相结合,用于构筑基因序列的多样性。我们期望这项成果对酿酒酵母菌株的定向进化、工业发酵性能如各种耐受性或产物产量提升有所帮助,并推动工业酶的进化和一些基础生物学问题的研究。”
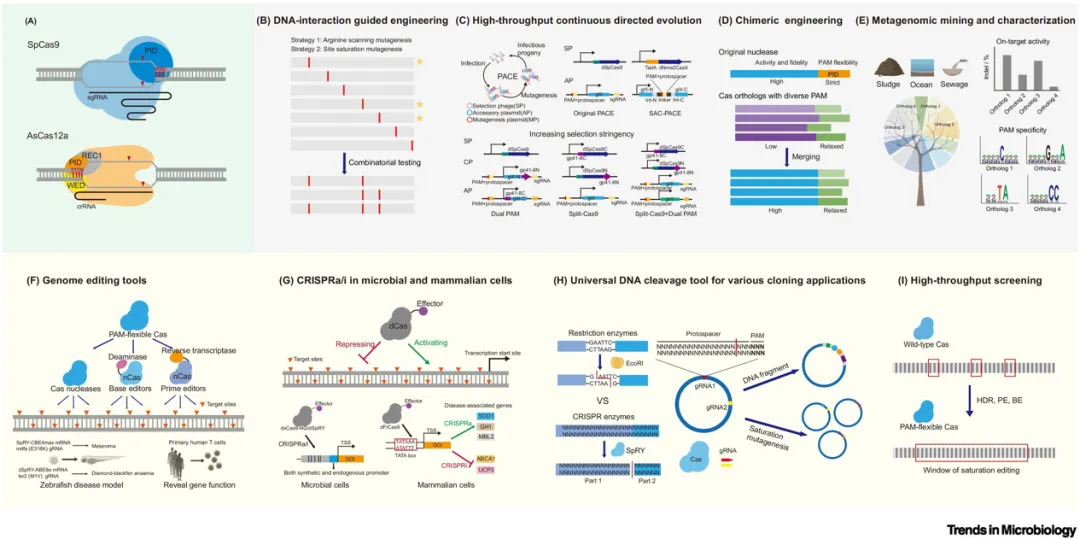
图2. 获得PAM宽松Cas蛋白的策略以及PAM宽松Cas蛋白的应用
基于此,团队在Trends in Microbiology上发表了综述观点文章,着重阐述了 Cas9 和 Cas12a 的 PAM 识别机制,并对近年来识别宽松 PAM 的 Cas 蛋白及其来源进行了梳理,总结了工程化改造 Cas 蛋白以放松 PAM 限制的多种方法,以及PAM宽松Cas蛋白对基因治疗、微生物改造、分子克隆及大规模遗传筛选可能带来的变革和尚需要克服的瓶颈(图2)。
新闻+
课题组近期招聘
课题组近期计划招收博士后2名,科研助理1名,感兴趣请邮件联系zbao@zju.edu.cn。课题组网站www.synthvo.org
导师简介
鲍泽华,浙江大学化学工程与生物工程学院“百人计划”研究员,科创中心求是科创学者,国家海外高层次青年人才项目入选者。以第一/通讯作者在Nat Biotechnol、Sci Adv、ACS Synth Biol、Trends Microbiol、IECR等期刊发表多篇高水平论文,担任BMC Biotechnology编委。主持国家高层次青年人才、国自然青年基金、国家重点研发计划子课题等各类项目。长期从事基因编辑和基因调控技术研究,主导开发了饱和基因编辑技术(Science Advances, 2024)、高通量单碱基精度基因组编辑技术(Nature Biotechnology, 2018)、多位点基因组编辑技术(ACS Synthetic Biology, 2015, ESI高被引论文)和可诱导正交多基因调控技术(ACS Synthetic Biology, 2017, F1000推荐论文)。



