肝癌是全球第七常见、死亡率第三高的癌症,而中国更是肝癌大国,肝癌发病率及死亡率分别达到了世界第四及第二,每年因肝癌死亡的人数更是达到了近33万,占全球肝癌死亡人数的42%。由于肝癌发病隐匿,大多数患者被诊断时已处于疾病晚期并失去了手术治疗的机会,包括介入治疗、化疗在内的综合治疗成为大多数晚期肝癌患者的唯一希望。
目前,包括介入治疗、化疗在内的综合治疗都存在疗效个体差异大、效果较差、副作用较大、容易耐药等问题,患者实际收益极其有限。近年来,各种新型肝癌治疗手段层出不穷,其中化学动力疗法(CDT)是目前最具有临床前景的新型治疗手段之一。CDT是指基于芬顿反应,利用无毒的纳米材料分解内源性生物分子双氧水,从而产生有毒的自由基杀死肿瘤细胞的新型疗法,具有无毒、肿瘤靶向性强的特点。但由于肿瘤内的双氧水浓度很低,单纯CDT治疗效果仍不太理想。

研究团队
浙江大学医学院附属第二医院王伟林教授团队和浙江大学高分子系毛峥伟教授团队首次将具有类葡萄糖氧化酶作用的超小金纳米粒子(Au NPs)原位结合在金属有机框架(MOF)上,以用于级联的化动力/饥饿治疗,有效解决了单纯化动力治疗效果不佳的难题,大大提高了对肝癌的治疗效果,为先进纳米药物研发提供了新的思路。
这一成果近期于国际知名期刊《先进科学》(Advanced Science)刊登,论文第一作者为浙江大学医学院附属第二医院肝胆胰外科丁元博士,论文通讯作者为浙江大学医学院附属第二医院王伟林教授、严盛教授和浙江大学高分子系毛峥伟教授。

纳米方舟的治疗原理示意图
找到“替身”,靶向直达
化疗弊端的症结在于化疗药,传统药物的先天不足的其中一个原因就是在复杂的人体环境中,传统化疗药物易受干扰,还未到达肿瘤就提前“引爆”。
肝癌的快速生长需要大量的能量,而这些能量来自于肝癌微环境中的葡萄糖。长期以来,科学家们都在利用这一原理,消耗肝癌微环境和细胞内的葡萄糖,通过资源耗竭的方法来抑制和延缓肝癌的生长。通过不懈研究,科学家们找到了一种“肿瘤特警”:葡萄糖氧化酶,这种氧化酶进入肝癌组织后,能够迅速“嗅出”葡萄糖的味道,进而快速消化肝癌微环境中的葡萄糖以杀灭肝癌细胞,这种治疗方法被称为肝癌“饥饿疗法”。
但是葡萄糖氧化酶这名“特警”十分金贵,作为一种人体内常见的蛋白质,其保存条件苛刻,重金属、高温、溶剂、酸碱条件都容易使其失去活性导致失效;进入体内后,在血液、组织中也存在大量的蛋白酶,可以使其降解失活。
能否找到一种物质取代“金贵”的葡萄糖氧化酶呢?浙大科研人员找到具有类似蛋白酶催化性质的金纳米粒子,这种粒子既能够有效渗透到肝癌深处,又可以高效地催化肝癌组织中葡萄糖,从而通过“饥饿疗法”杀灭肝癌细胞。
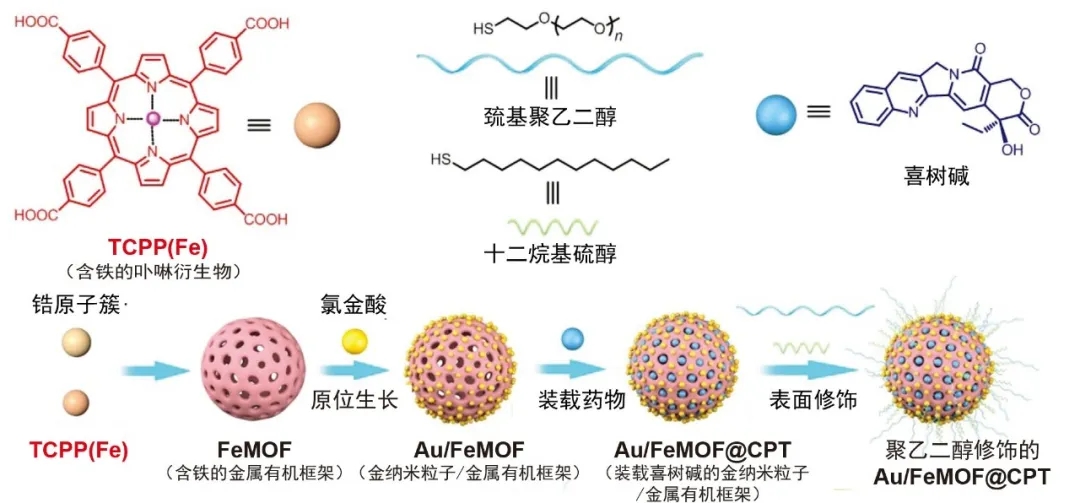
“纳米方舟”的制备过程示意图
装上“护甲”,乘风破浪
以前,肿瘤“饥饿疗法”的效果大多停留在抑制生长和延缓肝癌进展上,无法彻底治愈肝癌。那么真正的治本之法是什么呢?
相比于正常细胞,肝癌细胞内会积累更多的过氧化氢。通过催化剂(常见的如铁离子)的作用,过氧化氢能够分解产生有毒的羟基自由基杀死肝癌细胞,这种治疗方法被称为“化学动力治疗(CDT)”。
传统化疗用的药物是有毒的,在血液循环过程中不是被清除了,就是侵害了健康组织。而化学动力治疗本身是无毒的,只有到特定场所才产生有毒物质,“靶向”杀死肿瘤细胞。
遗憾的是,肝癌细胞内源过氧化氢含量不足,耗竭后会导致肿瘤细胞再次激增。过去,科学家们也尝试过提供外源的过氧化氢,但肿瘤组织周围“路况”复杂,很难精准“补给”到位。并且过氧化氢是“危化品”,很容易在运输途中“泄露”,损伤正常组织,导致严重的副作用。
为解决这一关键性问题,浙大科研人员设计了一种含铁的有机金属框架材料(MOF),其表面具有大量孔洞,到达肿瘤部位后会在特殊微环境的作用下快速分解,将铁离子释放出来进行化学动力治疗。同时,为了实现精准施药,科研人员利用MOF结构和特定的有机分子保护金纳米粒子,这就像一套“护甲”保护药物,使其只有在肿瘤微环境中才会将金纳米粒子暴露出来,并发挥分解葡萄糖、杀灭肝癌细胞的作用。
这样一来,科研人员将饥饿疗法与化学动力治疗有机结合在了一起。王伟林教授介绍,其实“饥饿疗法”与“化学动力治疗”本来就是“天生一对”,可以实现级联的化学反应,通过葡萄糖氧化分解,源源不断地产生过氧化氢,为芬顿反应提供燃料,产生更多的羟基自由基,这种“联袂合作”达到了理想的治疗效果,可谓肝癌治疗的“黄金搭档”。
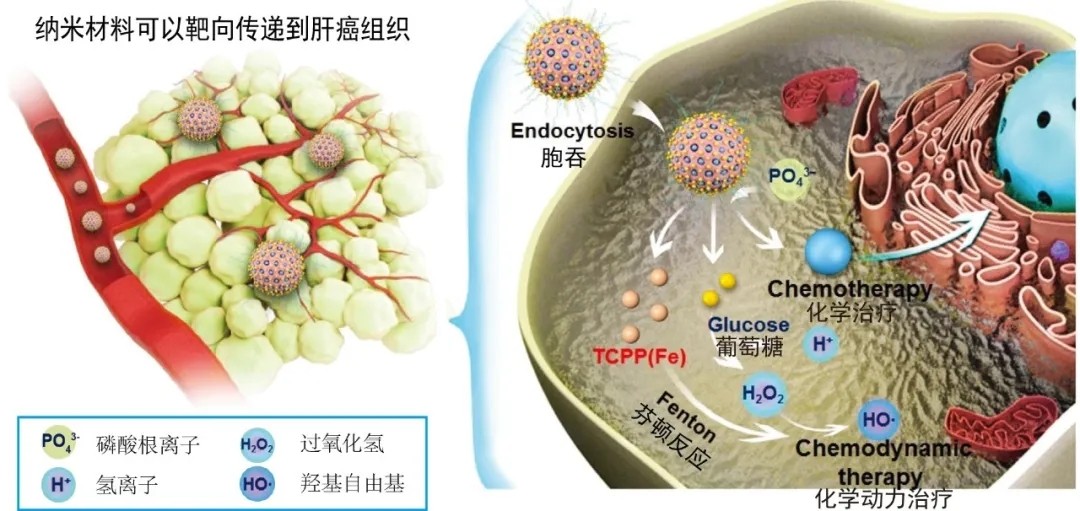
“纳米方舟”化学动力和饥饿疗法联合治疗肝癌示意图
前沿展望,抗癌药的纳米化或将带来更多希望
浙大团队的纳米药物研究将治标与治本有机结合起来,通过制造“纳米方舟”,让抗肝癌药物有一个更好的载体,穿越复杂的人体系统直达肝癌病灶。
毛峥伟教授介绍,团队研制的这种纳米药物在体外与体内实验中均被证实具有明显的抗肝癌作用,相比于传统化疗药,该药物的全身毒性大大降低。
纳米药物的研发提高了化疗药物的药物传递效率,也带来了新的治疗手段。毛峥伟认为,纳米技术作为两种经典治疗方法的桥梁,实现了这场抗癌“接力赛”。
浙大二院的科研人员表示,未来纳米药物能够得到临床应用,将很有可能一次性解决现有化疗药物面临的许多难题。一方面,该药相当于融合了两种抗癌疗法和纳米颗粒的优势,长期存在于肝癌组织中,不仅能直接杀死肝癌细胞,还能抑制肝癌中存活细胞的生长,大大提高了肝癌被治愈的可能;另一方面,纳米材料可以有针对性地只在肝癌组织内发挥作用,不会攻击其他正常组织,尽管具有强大的肝癌杀伤作用,但却仅会产生轻微的不良反应。
更值得注意的是,除了全身化疗外,这种药物还能在介入治疗和手术中发挥作用,通过在肝癌局部的注射,可以对一些早期肝癌和多发转移的肝脏肿瘤进行定点清除;而面对术中才能发现的一些微小、隐匿的病灶,该药的应用配合手术切除,则能最大程度地达到肝癌治愈,降低复发可能。
这项研究受到国家自然科学基金、浙江省重点研发计划项目等课题的资助。



